[2021 ВЪЂВаљ вХёВёЮ] (26)Рђўв▓ѕВДђВѕўРђЎ Въўвф╗ В░ЙВЮђ Kв░ћВЮ┤Вўц ьЎЇв│┤
2020вЁёВЌљ ВІюВъЉвљю ВйћвАювѓў19 вїђВюаьќЅвЈё вѓўвдёвїђвАю вДѕвг┤вдгЖ░ђ вЈ╝ Ж░ђЖ│а ВъѕвІц. ВўѕВЃЂв│┤вІц в░▒ВІа Ж░юв░юВЮ┤ в╣авЦ┤Ж▓ї ВЮ┤вБеВќ┤ВДё вЇЋвХёВЮ┤вІц. ВЋѕьЃђЖ╣їВџ┤ Ж▒┤, ЖиИ в░ўВъЉВџЕВю╝вАю ЖхГвѓ┤ ВаюВЋйВЌЁЖ│ёЖ░ђ ВА░вА▒ВЮў вїђВЃЂВю╝вАю ВаёвЮйьќѕвІцвіћ ВаљВЮ┤вІц. ВЮ╝вХђ ВаюВЋйВѓгВЌљВёю ьўИВќИВъЦвІ┤ьЋўвЇў РђўЖхГВѓ░ В╣ўвБїВаюРђЎВЎђ РђўЖхГВѓ░ в░▒ВІаРђЎВЮ┤ ВІцВаювАю вѓўВўцЖИ░віћ ьЋўвіљвЃљвіћ в╣ѕВаЋЖ▒░вд╝ВЮ┤ ВъѕвІц. ЖиИ в╣ёвѓюВЌљвЈё ВЮ╝вдгвіћ ВъѕвІц. ьЌѕьЎЕвљю Ж│ёьџЇВю╝вАю В╣ўвБїВаювЦ╝ вДївЊцЖ▓авІцвЇў ВаюВЋйВѓгвЊц, вІгВйцьЋю ВѓгьЃЋв░ювд╝ВЌљ ВєЇВЮђ ВаЋВ╣ўВЮИвЊцВЮ┤ Kв░ћВЮ┤ВўцвЮ╝віћ ЖИ░ВЮ┤ьЋю ВІаВА░Вќ┤вЦ╝ вДївЊцВќ┤ ЖИ░вїђЖ░љВЮё ВдЮьЈГВІюВ╝░ЖИ░ вЋївгИВЮ┤вІц. ЖиИвЪ░вЇ░ ВаЋВъЉ ЖхГвѓ┤ ВаюВЋйВЌЁЖ│ёЖ░ђ Ж░ђВДё ВДёВаЋьЋю Ж░ЋВаљВЮђ вХђьњђвацВДё ВІаВЋй Ж░юв░ю ВЌГвЪЅВЮ┤вЮ╝ЖИ░в│┤вІе в░ћВЮ┤ВўцВЮўВЋйьњѕ ВаюВА░ ВЌГвЪЅВЌљ ВъѕвІц. Kв░ћВЮ┤ВўцВЌљ вїђьЋю В░гв»ИЖ▒┤ ВДѕьЃђЖ▒┤ Ж░ёВЌљ ВЋаВ┤ѕВЌљ вЉў вІц в▓ѕВДђВѕўвЦ╝ Въўвф╗ В░ЙВЋўвІцвіћ Ж▓ЃВЮ┤вІц.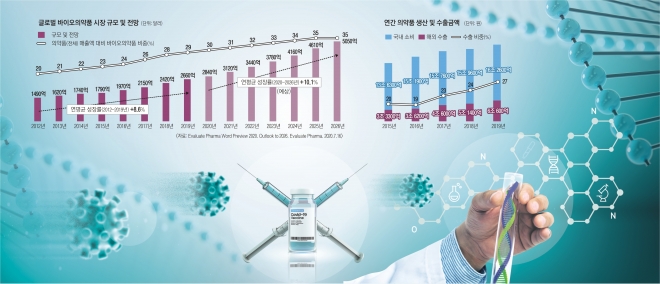
ьЋюЖхГВЮђ ВБ╝Вџћ ВёаВДёЖхГ ВцЉВЌљВёювЈё ВюавЈЁ ВаюВА░ВЌЁВЮ┤ В░еВДђьЋўвіћ в╣ёВцЉВЮ┤ вєњвІц. 2019вЁё ЖИ░Вцђ ЖхГвѓ┤В┤ЮВЃЮВѓ░(GDP)ВЮў 27.7%Ж░ђ ВаюВА░ВЌЁВЌљВёю в░юВЃЮьќѕвІц. Вѓ░ВЌЁЖхгВА░Ж░ђ вІцвЦИ в»ИЖхГ(11.6%)ВЮ┤вѓў ВўЂЖхГ(9.6%)ВЮђ вг╝вАа в╣ёВіиьЋю Вѓ░ВЌЁЖхгВА░вЦ╝ Ж░ђВДё вЈЁВЮ╝(21.6%)ВЮ┤вѓў ВЮ╝в│И(20.8%)в│┤вІцвЈё ьЎЋВЌ░ьъѕ вєњВЮђ ВѕўВ╣ўвІц. ВаюВА░ВЌЁ в╣ёВцЉВЮ┤ вєњВЮђ ьЋюЖхГ Вѓ░ВЌЁЖхгВА░віћ ВйћвАювѓў19 вїђВюаьќЅ ВІюЖИ░ ВІцвг╝Ж▓йВаювЦ╝ ВДђьЃ▒ьЋўвіћ вЇ░ вЈёВЏђВЮ┤ вљљВДђвДї, ВѓгВІц 15вЁёВЌг ВаёвХђьё░ вєњВЮђ ВаюВА░ВЌЁ в╣ёВцЉВЮђ Ж░юВёаьЋ┤ВЋ╝ ьЋа ьўёВЃЂВю╝вАю ВДђвфЕвљљвІц. вєњВЮђ ЖИ░ВѕаваЦВЮ┤ ьЋёВџћьЋю ВаюьњѕВЌљВёювіћ вХЂв»Ивѓў ВюавЪйВЮў ВёаВДё ЖИ░ВЌЁВЮё вЏ░Вќ┤вёўВДђ вф╗ьЋўЖ│а, Ж░ђЖ▓ЕЖ▓йВЪЂваЦВЮ┤ ВцЉВџћьЋю ВцЉ┬иВађВюёЖИ░Вѕа ВаюьњѕВЌљВёювіћ ВцЉЖхГВЮ┤вѓў ВЌгьЃђ Ж░юв░ювЈёВЃЂЖхГВЮў ВХћЖ▓ЕВЮё вќеВ│љвѓ┤ВДђ вф╗ьЋ┤ ьЋюЖхГ ЖИ░ВЌЁвЊцВЮ┤ Ж│аВѓгьЋўвдгвъђ РђўВЃївЊюВюёВ╣ў ВюёЖИ░вАаРђЎВЮ┤ ьџАьќЅьЋю ьЃЊВЮ┤вІц.
ВЮўВЋйьњѕ ВаюВА░ВЌЁВЮИ ВаюВЋйВЌЁвЈё ВЃЂьЎЕВЮ┤ ьЂгЖ▓ї вІцвЦ┤ВДђвіћ ВЋіВЋўвІц. ВЮўВЋйьњѕ в░ИвЦўВ▓┤ВЮИВЮў Ж░ђВъЦ в░Љв░ћвІЦВЮИ ВЏљвБї ВЮўВЋйьњѕ ВЃЮВѓ░ВЮђ ВЮ┤в»И ВцЉЖхГ, ВЮИвЈё вЊ▒ВЮў ЖхГЖ░ђЖ░ђ В░еВДђьЋю ВДђ ВўцвъўВўђЖ│а Жх│Ж▒┤ьЋю Ж▒┤Ж░Ћв│┤ьЌў ВаювЈёЖ░ђ ВІюв»╝ВЮў ВЮўвБїВДђВХюВЮё ВќхВаюьЋ┤ ВБ╝вІѕ вѓ┤ВѕўВІюВъЦВЮђ ВЃЂв░Е ьЋюЖ│ёвЈё вфЁьЎЋьќѕвІц. Вѓ░ВЌЁВаЂ Ж┤ђВаљВЌљВёювіћ ьЂ░ ВюёьЌўвХђвІ┤ВЮё ВДђЖ│а ВІаВЋй Ж░юв░юВЌљ ьѕгВъљьЋўвіћ Ж▓Ѓ ВЎИВЌљ вЙ░ВА▒ьЋю Вё▒ВъЦ ВаёвъхВЮ┤ ВЌєвЇў Ж▓ЃВЮ┤вІц. ЖиИваЄВДђвДї Ж│аВъЉ 20ВА░ВЏљвїђВЮў вѓ┤ВѕўВІюВъЦВЮё вХёВаљьЋўвіћ ЖхГвѓ┤ ВаюВЋйВѓгвЊцВЮ┤ ВЌ░вДцВХю ВѕўВІГВА░ВЏљВДювдг ЖИђвАюв▓ї вІцЖхГВаЂ ВаюВЋйВѓгвЊцЖ│╝ ВІаВЋй Ж░юв░юВЌљВёю Ж▓йВЪЂьЋювІцвіћ Ж▒┤ ьўёВІцВаЂВю╝вАю Вќ┤вацВџ┤ ВЮ╝ВЮ┤вІц. ЖиИвъўВёю ВЋёВБ╝ вЊювг╝Ж▓ї вѓўВўцвіћ ВЮ╝вХђ Вё▒Ж│хВѓгвАђвЊц ВЎИВЌљвіћ ВІаВЋй Ж░юв░юВЮў вєњВЮђ в▓йВЮё вёўвіћ ьџїВѓгЖ░ђ ВЌєВЌѕвІц. ьЏёв░юВБ╝ВъљВЌљЖ▓ївіћ ВХћЖ▓ЕвІ╣ьЋўЖ│а Ж│авХђЖ░ђЖ░ђВ╣ў ВаюВА░ВЌЁВю╝вАю ВаёьЎўьЋўвіћ Ж▓ЃВЌљвЈё ВІцьїеьќѕвЇў Ж▓ЃВЮ┤вІц. ВЮ┤вЪ░ ВаюВЋйВЌЁЖ│ёВЮў вѓюВ▓ўьЋю ВЃЂьЎЕВЮ┤ в░ћвђїЖ▓ї вљю Ж▒┤ в░ћВЮ┤ВўцВЮўВЋйьњѕВЮў ВІюВъЦ в╣ёВцЉВЮ┤ ьЈГв░юВаЂВю╝вАю ВдЮЖ░ђьЋўвЕ┤ВёювІц.
в░ћВЮ┤ВўцВЮўВЋйьњѕВЮ┤въђ РђўВЃЮвг╝В▓┤ВЌљВёю ВюавъўьЋўЖ▒░вѓў ВХћВХюьЋю ВЋйВџЕ вг╝ВДѕРђЎВЮ┤вЮ╝Ж│а ьЋа Вѕў ВъѕвІц. ВаЋВЮўВЌљВёю ВЋї Вѕў ВъѕвЊ» в▓ћВБ╝Ж░ђ вДцВџ░ вёЊВЮђвЇ░, ЖиИВцЉ ВхюЖи╝ВЌљ ВБ╝вфЕВЮё в░Џвіћ Ж▒┤ в░ћВЮ┤ВўцВЮўВЋйьњѕВЮў ьЋю вХёвЦўЖх░ВЮИ ьЋГВ▓┤ВЮўВЋйьњѕВЮ┤вІц. ВЃЮВєїьЋю вфЁВ╣ГВЮ┤Ж▓аВю╝вѓў ВЏљвдгвіћ вІеВѕюьЋўвІц. ьЋГВ▓┤ВЮўВЋйьњѕВЮђ ВЎИвХђВЌљВёю В╣еВъЁьЋю в»ИВЃЮвг╝ВЮё ВаЋьЎЋьъѕ ьЃђЖ▓ЕьЋўвіћ ьЋГВ▓┤ВЮў Вё▒ВДѕВЮё ЖиИвїђвАю в╣ївац, ВЮИВ▓┤ВЮў ВІаьўИВ▓┤Ж│ёВЌљВёю ВБ╝ВџћьЋю ВЌГьЋаВЮё вІ┤вІ╣ьЋўвіћ ВІаьўИ ВѕўВџЕВ▓┤ВЌљ Ж▓░ьЋЕьЋўвіћ ьЋГВ▓┤вЦ╝ ВЮИВюёВаЂВю╝вАю вДївЊцВќ┤ вѓИ Ж▓ЃВЮ┤вІц. ьЋГВ▓┤вЦ╝ ВЮ┤ВџЕьЋ┤ ВЮ┤вЪ░ ВѕўВџЕВ▓┤вЊцВЮё В░евІеьЋеВю╝вАюВЇе, ЖИ░ВА┤ВЌљ ВѓгВџЕьЋўвЇў ьЎћьЋЎьЋЕВё▒ ВЮўВЋйьњѕв│┤вІц вЇћ ВаЋьЎЋьЋўЖ│а ВЌёв░ђьЋўЖ▓ї ВЮИВ▓┤ВЮў ВЃЮвдгВъЉВџЕВЮё ВА░ВаѕьЋа Вѕў ВъѕЖ▓ї вљю Ж▓ЃВЮ┤вІц. ВхюЖи╝ в»ИЖхГ ВІЮьњѕВЮўВЋйЖхГ(FDA)ВЌљВёю ьЌѕЖ░ђвЦ╝ в░ЏВЮђ ВёИЖ│ё ВхюВ┤ѕВЮў В╣ўвДцВ╣ўвБїВаю ВЋёвЉљВ╣┤вѕёвДЎвЈё ВЮ┤вЪ░ ьЋГВ▓┤ВЮў Вё▒ВДѕВЌљ в╣џВЮё ВДђЖ│а ВъѕвІц. ВЮ┤В▓ўвЪ╝ ьЋГВ▓┤ВЮўВЋйьњѕВЮў ВъЦВаљВЮђ вДЅвїђьЋўВДђвДї, ЖиИвДїьЂ╝ вІеВаљвЈё вџюваиьЋўвІц. ВЃЮВѓ░Ж│╝ВаЋВЮ┤ ЖИ░ВА┤ ВЮўВЋйьњѕв│┤вІц вг┤В▓Ў Ж╣ївІцвАГЖИ░ вЋївгИВЮ┤вІц. ЖиИ Ж╣ївІцвАюВЏђ вЇЋвХёВЌљ ьЋюЖхГ ВаюВЋйВЌЁЖ│ёЖ░ђ ВЃѕвАюВџ┤ ЖИ░ьџївЦ╝ Ж▒░веИВЦљЖ▓ї вљљвІц.
РЌЈв»╝Ж░љьЋю РђўВЎђВЮИРђЎ Ж░ЎВЮђ в░ћВЮ┤ВўцВЮўВЋйьњѕ
в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ВЮ┤ Ж╣ївІцвАюВџ┤ ВЮ┤Вюавіћ ВЮ╝в░ўВаЂВЮИ ьЎћьЋЎьЋЕВё▒ ВЮўВЋйьњѕ ВЃЮВѓ░Ж│╝ вІгвдг ВЃЮВѓ░Ж│╝ВаЋВЌљВёю ВЃЮвг╝В▓┤вЦ╝ ВЮ┤ВџЕьЋўЖИ░ вЋївгИВЮ┤вІц. ьЎћьЋЎьЋЕВё▒ ВЮўВЋйьњѕВЮђ ЖИ░ВЌЁвДѕвІц ВѕўВюе(yield)ВЌљ вћ░вЦИ ВЃЮВѓ░вІеЖ░ђВЮў В░еВЮ┤віћ в░юВЃЮьЋа Вѕў ВъѕВДђвДї, ВаЋьЋ┤ВДё ВА░Ж▒┤ВЌљ вћ░вЮ╝ ьЎћьЋЎ Ж│хВаЋВЮё ВДёьќЅьЋўвЕ┤ Вќ╗Вќ┤ВДђвіћ Ж▓░Ж│╝вг╝ВЮђ Ж░ЎвІц. ВЮИвЈёВЮў вг┤ьЌѕЖ░ђ вХѕв▓Ћ ВЮўВЋйьњѕ Ж│хВъЦВЌљВёю В░ЇВќ┤вѓИ в│хВаюВЋйвЈё ВЮўВЋйьњѕ ВѕювЈё(purity)ВЮў ВИАвЕ┤ВЌљВёю вгИВаюЖ░ђ в░юВЃЮьЋа ВЌгВДђвіћ ВъѕВќ┤вЈё, вДївЊцВќ┤ВДё ВЋйвг╝ВЮђ ВЏљвъўВЮў ВЋйЖ│╝ вЈЎВЮ╝ьЋю ьџеЖ│╝вЦ╝ вѓ╝ Вѕў ВъѕвІц. В▓аВађьЋўЖ▓ї вфевЊа в│ђВЮИВЮ┤ ьєхВаювљўвіћ ьЎћьЋЎ Ж│хВаЋВЮў Вѓ░вг╝ВЮ┤вІц в│┤вІѕ ВЮ╝в░ўВаЂВЮИ Ж│хВѓ░ьњѕЖ│╝ ВюаВѓгьЋўЖ▓ї ВъгьўёВё▒ВЮ┤ вг┤В▓Ў вєњВЮђ Ж▓ЃВЮ┤вІц. ЖиИваЄВДђвДї в░ћВЮ┤ВўцВЮўВЋйьњѕВЮђ ВЮИЖ░ёВЮ┤ ВЃЮВѓ░ьЋўвіћ Ж▓ЃВЮ┤ ВЋёвІѕвЮ╝, ВЮИЖ░ёВЮ┤ ьѓцВџ░віћ ВЃЮвг╝В▓┤ВЌљВёю ВЃЮВѓ░вљювІц. ВхюВ▓евІе Ж│хВъЦВЌљВёю ВЃЮВѓ░вљўЖИ┤ ьЋўВДђвДї в│ИВДѕВаЂВю╝вАювіћ РђўВаюВА░РђЎЖ░ђ ВЋёвІѕвЮ╝ РђўвфЕВХЋРђЎВЌљ Ж░ђЖ╣їВџ┤ ВЮ╝ВЮ┤вІц.
ВаюВЋйВѓгЖ░ђ в░ћВЮ┤ВўцВЮўВЋйьњѕВЮё ВЃЮВѓ░ьЋўвіћ Ж│╝ВаЋВЮђ ВЮ┤ваЄвІц. ВЏљьЋўвіћ в░ћВЮ┤ВўцВЮўВЋйьњѕВЮё ВЃЮВѓ░ьЋўвЈёвАЮ ВюаВаёВаЂВю╝вАю Ж░ювЪЅвљю ВёИьЈг ВѕўВІГВќх Ж░ювЦ╝ Ж▒░вїђьЋю в░░ВќЉ ьЃ▒ьЂгВЌљ вёБЖ│а ВхюВаЂВЮў ВА░Ж▒┤ВЮё ВюаВДђьЋўвЕ░ ВёИьЈгвЊцВЮё ьѓцВџ░вЕ┤, ВёИьЈгвЊцВЮђ ВЏљьЋўвіћ в░ћВЮ┤ВўцВЮўВЋйьњѕВЮё ВЃЮВѓ░ьЋ┤ вѓИвІц. ВЮ┤вЦ╝ ВѕўьЎЋьЋ┤Вёю ВЮ┤вг╝ВДѕВЮё ВаюЖ▒░ьЋўЖ│а Въў ВаЋВаюьЋўвЕ┤ ВхюВбЁВаЂВю╝вАю ВЏљьЋўвіћ ВЋйьњѕВЮў ьўЋьЃювАю Ж░ђЖ│хВЮ┤ вљювІц. вгИВаювіћ ВЮ┤ Ж│╝ВаЋВЮ┤ вг┤В▓ЎВЮ┤вѓў в»╝Ж░љьЋўвІцвіћ Ж▓ЃВЮ┤вІц.
ВЎђВЮИ ВаюВА░вЦ╝ ВюёьЋ┤ вЈЎВЮ╝ьЋю ьњѕВбЁВЮў ьЈгвЈёвЦ╝ ьѓцВџ░вЇћвЮ╝вЈё ьєаВќЉВЌљ вћ░вЮ╝, ВЮ╝ВА░вЪЅ вЊ▒ВЮў ЖИ░ьЏёВА░Ж▒┤ВЌљ вћ░вЮ╝ ВЎђВЮИВЮў вЈЁьі╣ьЋю ьќЦв»ИВЮИ ьЁївБеВЋёвіћ вДцьЋ┤ ВА░ЖИѕВћЕ вІгвЮ╝ВДђвіћ Ж▓ЃЖ│╝ в╣ёВіиьЋўвІц. ВЎђВЮИ ВЋаьўИЖ░ђвЊцВЌљЖ▓ївіћ ЖиИ ВъљВ▓┤Ж░ђ ьЋўвѓўВЮў ВЮїв»И ВџћВєїЖ▓аВДђвДї, ЖиаВЮ╝ьЋю ВЮўВЋйьњѕВЮё ВЃЮВѓ░ьЋ┤ВЋ╝ ьЋўвіћ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ВЌљВёювіћ Ж│хВаЋ ВА░Ж▒┤ВЮў в»ИВёИьЋю в│ђьЎћвАювЈё ВаюьњѕВЮў ВДѕВЮ┤ вІгвЮ╝ВДђвіћ Ж▓ї вг┤В▓Ў ьЂ░ вѓюЖ┤ђВЮ┤вІц. Ж░ЎВЮђ Ж│хВъЦВЌљВёю ВЃЮВѓ░ьЋўвіћ в░ћВЮ┤ВўцВЮўВЋйьњѕвЈё ВъгьўёВё▒ВЮё ВюаВДђьЋўвіћ вЇ░ ВЋавЦ╝ ве╣вІц в│┤вІѕ, Ж░ђЖ▓ЕЖ▓йВЪЂваЦ ьЋўвѓўвДї в│┤Ж│а ЖИ░Вѕа ВѕўВцђВЮ┤ вѓ«ВЮђ Ж░юв░ювЈёВЃЂЖхГВЌљ ВЃЮВѓ░ВЮё ВЎИВБ╝ьЎћьЋўЖИ┤ ьъўвЊцвІц. ЖиИвЪ░вЇ░ ЖИ░ВѕаВаЂ ВЌГвЪЅВЮё Ж░ќВХћЖ│авЈё ВБ╝Вџћ ВёаВДёЖхГВЌљ в╣ёьЋ┤ ВХЕвХёьЋю Ж░ђЖ▓ЕЖ▓йВЪЂваЦВЮё Ж░ђВДё Ж││ВЮ┤ в░ћвАю ьЋюЖхГВЮ┤ВЌѕвІц.
ЖхГвѓ┤ВЌљВёювіћ 2005вЁё ВЁђьіИвдгВўеВЮ┤ в»ИЖхГ BMSВѓгВЎђ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВюёьЃЂВЃЮВѓ░ Ж│ёВЋйВЮё вД║Ж│а вїђЖиювфе в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ВаёВџЕ Ж│хВъЦВЮё ВёцвдйьЋю Ж▓ЃВЮё ВІюВъЉВю╝вАю 2011вЁёвХђьё░ Вѓ╝Вё▒в░ћВЮ┤ВўцвАюВДЂВіцЖ░ђ вїђЖиювфе в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ ьЎЋВХЕВЮё ВІюВъЉьЋ┤ 2021вЁё ЖИ░Вцђ вІеВЮ╝ ЖИ░ВЌЁВю╝вАювіћ ВёИЖ│ё Вхювїђ ВѕўВцђВЮў в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ВЌГвЪЅВЮё ьЎЋв│┤ьќѕвІц.
ВЮ┤віћ ЖхгВ▓┤ВаЂВЮИ ВѕўВ╣ўвАювЈё вЊювЪгвѓўвіћвЇ░, 2015вЁё ЖИ░Вцђ ЖхГвѓ┤ ВЮўВЋйьњѕ ВЃЮВѓ░вЪЅВЮў 20%ВЮИ 3ВА░ 3000ВќхВЏљВќ┤В╣ўЖ░ђ ьЋ┤ВЎИвАю ВѕўВХювљљВДђвДї, 5вЁё ВѓгВЮ┤ВЌљ ВЮ┤ ЖИѕВЋАВЮђ 2в░░ Ж░ђЖ╣їВЮ┤ віўВќ┤вѓгвІц. 2019вЁё ВаёВ▓┤ ВЮўВЋйьњѕ ВЃЮВѓ░ВЋАВЮў 27%ВЮИ 6ВА░ 600ВќхВЏљВќ┤В╣ўЖ░ђ ьЋ┤ВЎИвАю ВѕўВХювљю Ж▓ЃВЮ┤вІц. 2020вЁёЖ│╝ 2021вЁёВЌљ ВйћвАювѓў19 вїђВюаьќЅВю╝вАю ВЮИьЋ┤ в░юВЃЮьЋю ВХћЖ░ђВаЂВЮИ в░▒ВІа ВюёьЃЂВЃЮВѓ░ ВѕўВџћ вЊ▒ВЮё Ж│авацьЋўВДђ ВЋівЇћвЮ╝вЈё, ЖхГвѓ┤ ВаюВЋйВѓ░ВЌЁВЮђ ВЮ┤в»И Ж░ЋваЦьЋю в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ВЌГвЪЅВЮё Ж░ќВХћЖ│а ЖИ░ВА┤ВЮў ьЎћьЋЎ ьЋЕВё▒ВЮўВЋйьњѕ ВЃЮВѓ░ВЌљВёю Ж│авХђЖ░ђЖ░ђВ╣ў ВўЂВЌГВЮИ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░Вю╝вАю вёўВќ┤Ж░ђЖ│а ВъѕВЌѕвІцвіћ Ж▓ЃВЮ┤вІц. ЖиИвЪ░вЇ░ ВЮ┤вЪ░ ВХћВёИЖ░ђ ВЮ╝ВІюВаЂВЮИ Ж▓ЃВЮђ ВЋёвІљЖ╣ї? Ж▓░вАавХђьё░ вДљьЋўвЕ┤ ЖиИвЪ┤ Ж░ђвіЦВё▒ВЮђ ВъЉвІц.

в░ЋьЋюВіг ВЋйВѓг
В▓Ф в▓ѕВДИ ВЮ┤Вюавіћ В┤ѕЖИ░ВЌљ Ж░юв░ювљю вИћвАЮв▓ёВіцьё░ ьЋГВ▓┤ВЮўВЋйьњѕвЊцВЮў ьі╣ьЌѕЖ░ђ ВаљВ░е вДївБївљўЖ│а ВъѕЖИ░ вЋївгИВЮ┤вІц. ВЮўВЋйьњѕ ВѕўВХюВЋАВЮ┤ віўВќ┤вѓю Ж▒┤ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВюёьЃЂВЃЮВѓ░ВЮ┤ віўВќ┤вѓю ВўЂьќЦвЈё ВъѕВДђвДї, ЖхГвѓ┤ ЖИ░ВЌЁвЊцВЮ┤ ьі╣ьЌѕЖ░ђ вДївБївљю в░ћВЮ┤ВўцВЮўВЋйьњѕ ВІюВъЦВЮё вЁИвдгЖ│а в│хВаюВЋйВЮИ в░ћВЮ┤ВўцВІюв░ђвЪг Ж░юв░юВЌљ ВаЂЖи╣ВаЂВю╝вАю ьѕгВъљьќѕЖИ░ вЋївгИВЮ┤ЖИ░вЈё ьЋўвІц. в│хВаюВЋйВЮ┤вЮ╝Ж│авіћ ьЋўвѓў в░ћВЮ┤ВўцВІюв░ђвЪг ВЃЮВѓ░ВЮё ВюёьЋю Вёцв╣ё ВъљВ▓┤віћ ВўцвдгВДђвёљ в░ћВЮ┤ВўцВЮўВЋйьњѕЖ│╝ Ж░ЎЖ│а, ВІцВаювАю ВЃЮВѓ░вљю в░ћВЮ┤ВўцВІюв░ђвЪгЖ░ђ ВўцвдгВДђвёљ в░ћВЮ┤ВўцВЮўВЋйьњѕЖ│╝ Вќ╝вДѕвѓў ВюаВѓгьЋюВДђвЦ╝ Ж▓ђВдЮв░ЏВДђ вф╗ьЋўвЕ┤ ьЌѕЖ░ђвЦ╝ в░ЏВДђ вф╗ьЋўЖИ░ВЌљ ВюёьЃЂВЃЮВѓ░ вЊ▒Вю╝вАю ЖИ░ВѕаВХЋВаЂВЮ┤ ВЮ┤вБеВќ┤ВДђВДђ ВЋіВЮђ Ж││ВЌљВёювіћ Ж░юв░ю ВъљВ▓┤ВЌљ вЈёВаёьЋўвіћ Ж▓ЃвЈё ВЅйВДђ ВЋівІц. 2025вЁёЖ╣їВДђ ВЌ░вДцВХю ВѕўВА░ВЏљвїђВЮў вИћвАЮв▓ёВіцьё░ ьЋГВ▓┤ВЮўВЋйьњѕвЊцВЮ┤ ВѕюВ░еВаЂВю╝вАю ьі╣ьЌѕЖ░ђ вДївБївљювІц. ВДЂВаЉ в░ћВЮ┤ВўцВІюв░ђвЪгвЦ╝ Ж░юв░юьЋўвіћ Ж▓ї Ж░ђВъЦ ВбІЖ▓аВДђвДї, ЖиИваЄВДђ вф╗ьЋювІцЖ│а ьЋўвЇћвЮ╝вЈё в░ћВЮ┤ВўцВІюв░ђвЪгвЦ╝ ВъљВ▓┤ВаЂВю╝вАю ВЃЮВѓ░ьЋа ВЌГвЪЅВЮё Ж░ќВХў ВаюВЋйьџїВѓгвіћ ВёИЖ│ёВЌљВёювЈё ВєљВЌљ Ж╝йвіћвІц. в░ћВЮ┤ВўцВІюв░ђвЪг ВъљВ▓┤ Ж░юв░юВЮ┤ ВЋёвІї в░ћВЮ┤ВўцВІюв░ђвЪг ВюёьЃЂВЃЮВѓ░вДїВЮё вЁИвдгвЇћвЮ╝вЈё Вѓ░ВЌЁВаЂ ВѕўВџћЖ░ђ ВХЕвХёьъѕ ьЂ░ ВЁѕВЮ┤вІц.
вЉљ в▓ѕВДИ ВЮ┤Вюавіћ ьЋюЖхГВЮ┤ ВЮўВЋйьњѕВЮў вїђьЉюВаЂВЮИ в╣ёЖ┤ђВёИ ВъЦв▓йВЮИ ьўёВъЦВІцВѓг(due diligence)ВЌљВёю ВъаВъгВаЂВЮИ ьЏёв░юВБ╝Въљ ЖхГЖ░ђвЊцВЌљ в╣ёьЋ┤ ВЃЂвїђВаЂВю╝вАю ВъљВюавАГвІцвіћ ВаљВЮ┤вІц. ВЮўВЋйьњѕВЮў ьњѕВДѕЖ┤ђвдгвіћ ВхюВбЁ ВЃЮВѓ░вг╝ВЌљ вїђьЋю Ж▓ђВдЮвЈё ВцЉВџћьЋўВДђвДї, ВЃЮВѓ░Ж│╝ВаЋ ВъљВ▓┤вЦ╝ Ж▓ђВдЮьЋўвіћ в░ЕВІЮВю╝вАю ВЮ┤вБеВќ┤ВДёвІц. Ж░юв│ё Ж│хВаЋВЮ┤ ВаювїђвАю ВЮ┤вБеВќ┤ВДђвЕ┤ ВхюВбЁ ВЃЮВѓ░вг╝ВЮ┤ Въўвф╗вља Ж░ђвіЦВё▒вЈё ВъЉвІе вЁ╝вдгвІц. ВЮ┤вЦ╝ ЖиюЖ▓ЕьЎћьЋю Ж▓ЃВЮ┤ Вџ░ВѕўВЮўВЋйьњѕ ВаюВА░ в░Ј ьњѕВДѕЖ┤ђвдг ЖИ░Вцђ(GMP)ВЮ┤вЮ╝ вХѕвдгвіћ ЖИ░ВцђВЮИвЇ░, вѓўвдёВЮў ьєхВЮ╝Вё▒ВЮђ ВъѕВю╝вѓў ЖхГЖ░ђв│ё Ж│аВюа ЖиюВаю ЖХїьЋюВЮ┤вІц в│┤вІѕ ВІцВДѕВаЂВю╝вАювіћ в╣ёЖ┤ђВёИ ВъЦв▓йВю╝вАю ВъЉВџЕьЋўвіћ Ж▓йВџ░Ж░ђ ВъдвІц.
ВЮ┤вЪ░ вгИВаювЦ╝ ьЋ┤Ж▓░ьЋўЖИ░ ВюёьЋ┤ ВюавЪйВЌ░ьЋЕВЮё ВцЉВІгВю╝вАю ВЃЂьўИ Ж░ёВЮў ВІцВѓгвЦ╝ вЕ┤ВаюьЋ┤ ВБ╝віћ ЖхГВаю ВА░ВДЂВЮИ ВЮўВЋйьњѕВІцВѓгВЃЂьўИьўЉваЦЖИ░Жхг(PIC/S)Ж░ђ ВёцвдйвљљвіћвЇ░, ьЋюЖхГВЮђ 2014вЁёВЌљ Ж░ђВъЁ Ві╣ВЮИВЮё в░ЏВЋўвІц. ЖхГвѓ┤ВЌљВёю ВЃЮВѓ░вљю в░ћВЮ┤ВўцВЮўВЋйьњѕВЮё ВюавЪй ЖхГЖ░ђВЌљ ВѕўВХюьЋа вЋї, ьЋюЖхГ ВІЮВЋйВ▓ўВЮў ВІгВѓгвДїВю╝вАювЈё в│ёвІцвЦИ ВХћЖ░ђВаЂВЮИ ВІцВѓг ВЌєВЮ┤ ВѕўВХюьЋа Вѕў ВъѕЖ▓ї вљю Ж▓ЃВЮ┤вІц. ьЏёв░юВБ╝Въљ ЖхГЖ░ђВЮў ЖИ░ВЌЁВЮ┤ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВюёьЃЂВЃЮВѓ░ вЊ▒ВЌљ ВДёВХюьЋювІцЖ│а ьЋўвЇћвЮ╝вЈё, ВІаЖию Ж░ђВъЁЖхГВЮ┤ Ві╣ВЮИВЮё в░Џвіћ вЇ░віћ 4вЁёВЌљВёю 6вЁё ВаЋвЈёЖ░ђ Ж▒Ивд░вІц. ВДђЖИѕ вІ╣ВъЦ ВІаВ▓ГьЋўвЇћвЮ╝вЈё вїђЖиювфе в░ћВЮ┤ВўцВЮўВЋйьњѕ ьі╣ьЌѕ вДївБї ВІюЖИ░вЦ╝ вёўЖИ░вІѕ, ьі╣ьЌѕ вДївБї ьЏё В┤ѕЖИ░ ВІюВъЦ ВёаВаљВЮ┤ ВцЉВџћьЋю в│хВаюВЋй ВІюВъЦВЌљВёю ьЋюЖхГВѓ░ в░ћВЮ┤ВўцВЮўВЋйьњѕВЮђ ьЂ░ Ж░ЋВаљВЮё ВДђвІївІцЖ│а ьЋа Вѕў ВъѕвІц.
ВёИ в▓ѕВДИ ВЮ┤Вюавіћ ЖхГвѓ┤ ВаюВЋйВЌЁЖ│ёЖ░ђ ьўёВъг в░ћВЮ┤ВўцВЮўВЋйьњѕВЮў ВБ╝вЦўВЮИ ьЋГВ▓┤ВЮўВЋйьњѕ ВЃЮВѓ░ ВЎИВЮў В░еВёИвїђ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ ВІюВёцвЈё ВХЕвХёьъѕ Ж░ќВХћЖ│а ВъѕвІцвіћ ВаљВЮ┤вІц. Ж░ђва╣ ВйћвАювѓў19 в░▒ВІа Ж░юв░ю вЇЋВЌљ ВБ╝вфЕв░ЏЖ│а Въѕвіћ mRNA ВЮўВЋйьњѕВЮў Ж▓йВџ░ ьЋГВ▓┤ВЮўВЋйьњѕ ВЃЮВѓ░Ж│╝віћ Ваёьўђ вІцвЦИ ВюаьўЋВЮў Ж│хВаЋВЮ┤ ВџћЖхгвљювІц. ВЋйьџевЦ╝ вѓўьЃђвѓ┤віћ ьЋхВІг вг╝ВДѕВЮИ mRNAвіћ в»ИВЃЮвг╝ВЮё в░░ВќЉьЋўвіћ в░ЕВІЮВЮё ьєхьЋ┤ Вќ╗Вќ┤вѓ┤Ж│а, Вќ╗Вќ┤ВДё mRNAвЦ╝ ВЋѕВаёьЋўЖ▓ї Ж░љВІИвіћ ВЌГьЋаВЮё ьЋўвіћ ВДђВДѕвѓўвЁИВъЁВъљ(Lipidnanoparticle┬иLNP)віћ ьЎћьЋЎ Ж│хВаЋВЮё ьєхьЋ┤ Вќ╗Вќ┤ВДёвІц. ЖиИвЪ░вЇ░ ЖхГвѓ┤ ВаюВЋйВЌЁЖ│ёвіћ Ж░ЂЖ░ЂВЮё ВаюВА░ьЋа Вѕў Въѕвіћ Вёцв╣ёвЦ╝ ВЮ┤в»И Ж░ќВХћЖ│а ВъѕвІц. вІцвДї mRNA в░▒ВІаВЮђ ВІцВаювАю ВЮ┤вЦ╝ ВЃЮВѓ░ьЋ┤ в│И ВаёваЦВЮ┤ ВЌєвіћ вЇ░вІц ьўёВъгЖ╣їВДђ ьЌѕЖ░ђвЦ╝ в░ЏВЮђ в░▒ВІа Ж░юв░юВѓг вЉљ Ж││ВЮ┤ Ж░ЂЖ░Ђ ВъљВ▓┤ ВЃЮВѓ░, вІцвЦИ ЖИ░ВЌЁвЊцЖ│╝ ВюёьЃЂВЃЮВѓ░ Ж│ёВЋйВЮё вД║ВЌѕЖИ░ВЌљ ЖхГвѓ┤ВЌљВёю ВюёьЃЂВЃЮВѓ░ВЮё ВДёьќЅьЋўЖ│а ВъѕВДђ вф╗ьЋа в┐љВЮ┤вІц. ВйћвАювѓў19 вїђВюаьќЅВЮ┤ Вќ┤віљ ВаЋвЈё ВДёВаЋвљўЖ│а вѓўвЕ┤ ВЮ┤вЊц ЖИ░ВѕаВЌљ ЖИ░в░ўьЋю ВЮўВЋйьњѕ Ж░юв░юЖ│╝ ВЃЮВѓ░ВЮё ВДёьќЅьЋа ВЌгВДђЖ░ђ ьЂгвІѕ ВХћьЏё ьЋГВ▓┤ВЮўВЋйьњѕВЌљ вїђьЋю ВѕўВџћЖ░ђ ВцёВќ┤вЊцвЇћвЮ╝вЈё вїђВЮЉьЋа ВЌгваЦВЮђ ВХЕвХёьЋўвІц. вІеЖИ░ВаЂВЮИ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ ВѕўВџћвіћ вг╝вАа ВъЦЖИ░ВаЂВЮИ в░ћВЮ┤ВўцВЮўВЋйьњѕ ВЃЮВѓ░ ВѕўВџћВЌљВёювЈё вХђВА▒ьЋеВЮ┤ ВЌєвІцЖ│а ьЋа Вѕў ВъѕвІц.
РЌЈKв░ћВЮ┤Вўцвіћ вѓАВЮђ ВЮ┤ьЋ┤Ж░ђ вДївЊа ьЌѕВЃЂВЮ╝ в┐љ
Вѓ┤ьј┤в┤цвЊ», ЖхГвѓ┤ ВаюВЋйЖИ░ВЌЁВЮ┤ Ж░ђВДё ВДёВаЋьЋю ВЌГвЪЅВЮђ вІеЖИ░Ж░ёВЌљ ВІаВЋйВЮё Ж░юв░юьЋ┤ вѓ┤віћ Ж▓Ѓв│┤вІе ВЮ┤вЦ╝ ВЮўВЋйьњѕВЮў ьўЋьЃювАю ВЃЮВѓ░ьЋўвіћ ВаюВА░ ВЌГвЪЅВЌљ ВъѕвІц. ВЌгвЪг в░ЕьќЦВю╝вАю ВъЁЖИИВЌљ ВўцвЦ┤вЇў Kв░ћВЮ┤Вўцвіћ ВаюВЋйВѓ░ВЌЁВЌљ вїђьЋю вѓАВЮђ ВЮ┤ьЋ┤Ж░ђ вДївЊа ьЌѕВЃЂВЮ╝ в┐љВЮ┤вІц. ьўёВъгВЮў Вѓ░ВЌЁ ьўёьЎЕВЌљ вїђьЋю в░ћвЦИ ВЮ┤ьЋ┤вЦ╝ ьєхьЋ┤ ВЌЅвџ▒ьЋю В░гв»ИВЎђ в░ЕьќЦ ВъЃВЮђ в╣ёвѓюВЮ┤ вЕѕВХћЖИИ в░ћвъђвІц.
Рќав░ЋьЋюВіг В░еВЮўЖ│╝ьЋЎвїђ ВЋйьЋЎЖ│╝вЦ╝ ВАИВЌЁьЋўЖ│а вІцВќЉьЋю ВађВѕа ьЎювЈЎВЌљ ВаёвЁљьЋўЖ│а ВъѕвІц. ВађВёювАювіћ ВЋйВЮў ВъЉВџЕВЏљвдгвЦ╝ ьњђВќ┤ ВЊ┤ РђўВўцвіўвЈё ВЋйВЮё ве╣ВЌѕВіхвІѕвІцРђЎВЎђ ьѕгВъљВъљ Ж┤ђВаљВЌљВёю в░ћвЮ╝в│И ВаюВЋй┬ив░ћВЮ┤ВўцВѓ░ВЌЁ Ж░ювАаВёю Рђўв░ћВЮ┤Вўц ьѕгВъљВЮў ВаЋВёЮРђЎВЮ┤ ВъѕвІц.
2021-06-18 27вЕ┤
Copyright РЊњ ВёюВџИВІавгИ All rights reserved. вг┤вІе ВаёВъг-Въгв░░ьЈг, AI ьЋЎВіх в░Ј ьЎюВџЕ ЖИѕВДђ






![thumbnail - Ж╣ђВаЋВЮђ Рђюьі╣в│ёьЋю Вёавг╝РђЮРђдВЋёв╣а ВўєВЌљВёю ВађЖ▓ЕВєїВ┤Ю ВЈўвіћ Ж╣ђВБ╝ВЋа [ьЈгВ░Е]](https://img.seoul.co.kr/img/upload/2026/02/28/SSC_20260228094816_N2.jpg.webp)

































